BiteSized Immunology: Patógenos y Enfermedades

Biofilms y su papel en la patogénesis
¿Qué es un biofilm?
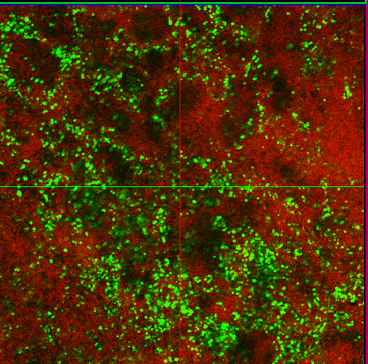
Uno de los errores que cometemos cuando pensamos en microorganismos es que éstos viven en formas individuales y en “estado planctónico”. Nada de eso. Los microorganismos se acumulan de forma natural en una gran variedad de superficies, donde forman comunidades sedentarias y sésiles. Estas superficies incluyen tuberías domésticas e industriales, biomateriales como las lentes de contacto, o aparatos médicos como implantes o catéteres urinarios, así como tejidos de plantas y animales. La acumulación de estos agregados de microorganismos en forma mono- o polimicrobiana se conoce como biofilm y puede estar compuesto de distintas comunidades bacterianas y fúngicas. La cercanía entre microorganismos permite el intercambio de nutrientes, la distribución de productos moleculares y la eliminación de productos tóxicos, de manera que cada especie ayuda a las demás. Además, la estructura del biofilm puede proteger a sus componentes de moléculas antimicrobianas, fuerzas de tracción e incluso del sistema inmunitario. Un ejemplo de biofilm con dos especies de bacterias, Pseudomonas aeruginosa y Staphylococcus epidermis, puede verse en la Figura 1.
¿Cómo se forman?
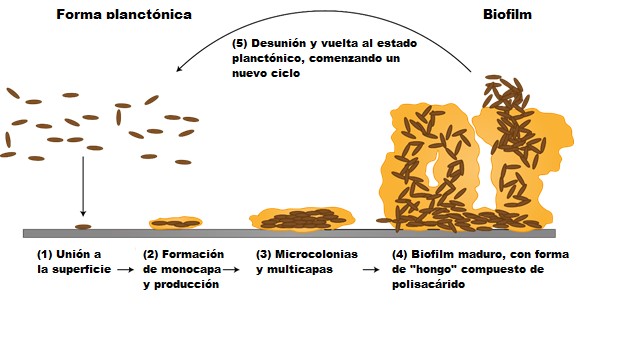
La formación de biofilms ocurre en cinco pasos: anclaje inicial reversible (1), anclaje irreversible (2-3), maduración (4) y dispersión (5), tal y como se muestra en la figura 2. El primer paso consiste en la adhesión de bacterias planctónicas a la superficie, que puede revertirse en cualquier momento. Una vez anclada, se comenzará a formar una monocapa bacteriana y a producirse una matriz extracelular de protección. Esta matriz consta de polisacáridos extracelulares, proteínas extracelulares, restos celulares y ácidos nucleicos, cada uno de los cuales se conocen como sustancias poliméricas extracelulares (EPS). El ADN extracelular es el primer compuesto que aparece durante la formación de la matriz, mientras que los polisacáridos y las proteínas estructurales aparecen después. Una vez formada, la matriz favorece el crecimiento bacteriano y la comunicación célula-célula, esta última conocida como quorum sensing. Los biofilms crecen en forma tridimensional, y en este momento, la adhesión a la superficie es irreversible. En el último paso, algunas células del biofilm maduro empiezan a desunirse y dispersarse nuevamente por el ambiente como células planctónicas para comenzar un nuevo ciclo.
El papel de los biofilms en la patogénesis
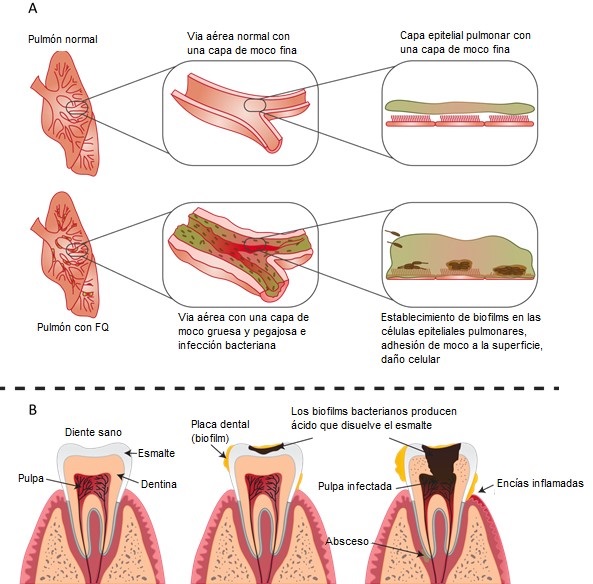
Los biofilms se pueden encontrar en, prácticamente, cualquier sitio y pueden tener un impacto en la salud humana tanto positivo como negativo. Un ejemplo de impacto positivo serían los biofilms de bacterias comensales, como Staphylococcus epidermidis, que impiden la colonización de potenciales bacterias patógenas a través de la estimulación de las células inmunitarias y previniendo su adhesión. Sin embargo, los biofilms están más asociados con enfermedades en humanos e infecciones en plantas. Un ejemplo típico es la fibrosis quística, una de las enfermedades genéticas más frecuentes en Europa del Oeste. Los pacientes con fibrosis quística (FQ) sufren infecciones crónicas de P. aeruginosa. Cuando ésta infecta un pulmón con FQ, sufre una transición de patógeno virulento a patógeno adaptado, que le permite residir en el tejido durante años o décadas. Esto es debido a la sobreproducción del polisacárido de matriz alginato, que promueve la formación de un biofilm resistente a antibióticos, respuestas inmunitarias innatas y adaptativas y fagocitosis. La persistencia del biofilm en los tejidos pulmonares provoca una respuesta de anticuerpos, que se traduce en inflamación crónica por mediación de granulocitos y provoca daño severo en el pulmón (ver Figura 3A). Un segundo ejemplo de biofilm con un impacto negativo en la salud humana es la placa dental, que puede dar lugar a caries. El consumo de carbohidratos fermentables como dulces o bebidas azucaradas provoca un incremento en la producción y secreción de ácidos orgánicos por las bacterias que se encuentran en la placa dental. Si no se trata, el incremento de la acidez del biofilm acarrea la desmineralización del esmalte y la formación de caries dental (ver Figura 3B).
Perspectivas futuras
Dado su papel en la aparición y desarrollo de enfermedades y su resistencia frente a numerosos tratamientos microbianos, en los últimos tiempos el estudio de los biofilm está recibiendo mucha atención. El foco de investigación ya no se centra únicamente en frenar el crecimiento o división bacteriano, dado el continuo incremento de resistencias frente a antimicrobianos, sino que se están desarrollando nuevas estrategias. Ejemplos serían nuevos mecanismos que favorecen la dispersión de los componentes del biofilm o medidas para prevenir la adhesión inicial, por ejemplo, mediante la modificación de la superficie de compuestos susceptibles de ser colonizados como los catéteres urinarios o los implantes.
La versión en español ha sido coordinada por Jesús Gil-Pulido, responsable de redes sociales de la Sociedad Española de Inmunología, y ha sido posible gracias a miembros de la Sociedad Española de Inmunología (https://www.inmunologia.org/index.php)
